修回日期: 2011-06-21
接受日期: 2011-06-28
在线出版日期: 2011-07-08
目的: 建立一种稳定的成人原代肝细胞分离、培养、冻存方法, 为肝细胞移植、生物人工肝支持系统治疗急慢性肝病以及肝细胞体外应用模型提供潜在的肝细胞资源.
方法: 20例供肝采用离体两步胶原酶灌注技术分离成人原代肝细胞. 选择7个不同的预培养时间点(2、6、12、24、36、48和72 h), 分离所获肝细胞按上述不同预培养时间在4 ℃人无血清培养基(HepatoZYME-SFM)中培养, 然后收集预培养肝细胞转移到含100 mL/L胎牛血清和DMSO的HepatoZYME-SFM中, 再立即放入-80 ℃异丙醇冷冻盒过夜, 次日投入液氮. 分析比较各肝细胞在解冻后细胞活力率、贴壁率、白蛋白分泌及尿素合成.
结果: 在部分肝叶切除后使用离体两步胶原酶灌流技术分离所得肝细胞活率和贴壁率分别是75.0%±4.6%和72.0%±6.0%. 4 ℃预培养12或24 h被证明是最适预培养时间, 这两个时间点的白蛋白分泌高于其他时间点(P<0.05). 与立即冷冻组相比较, 预培养12或24 h肝细胞解冻后活力(61.4%±4.8%, 62.0%±5.6% vs 53.4%±4.2%)、贴壁率(63.2±5.8%, 62.6±3.6% vs 55.2±4.6%)、白蛋白分泌及尿素合成水平明显提高(均P<0.05).
结论: 人肝细胞在冷冻前4 ℃预培养12-24 h可以获得较理想的肝细胞, 为药理毒理学、生物人工肝以及细胞治疗的临床应用提供了可能性.
引文著录: 杭化莲, 张磊, 施晓雷, 卞建民, 丁义涛. 成人原代肝细胞的分离、培养及冻存. 世界华人消化杂志 2011; 19(19): 2016-2021
Revised: June 21, 2011
Accepted: June 28, 2011
Published online: July 8, 2011
AIM: To establish a stable method for the isolation, culture and cryopreservation of adult primary hepatocytes to provide a potential hepatocyte resource for the treatment of acute and chronic liver diseases using hepatocyte transplantation and bioartificial liver support systems, and for the use of hepatocytes as an in vitro model of the liver.
METHODS: Adult hepatocytes were isolated from 20 separate donors using a two-step extracorporeal collagenase perfusion technique. The hepatocytes were preincubated in HepatoZYME-SFM medium for 2, 6, 12, 24, 36, 48 or 72 h, transferred to HepatoZYME-SFM medium containing 10% FBS and 10% DMSO, immediately put into an isopropanol progressive freezing container at -80 ℃ overnight, and immersed in liquid nitrogen the next day. During the post-thaw culture period, cell viability, plating efficiency, albumin secretion and urea synthesis were analyzed.
RESULTS: The viability and plating efficiency of hepatocytes isolated using the two-step extracorporeal collagenase perfusion technique were 75.0% ± 4.6% and 72.0% ± 6.0%, respectively. Preincubation at 4 ℃ for 12 or 24 hours proved to be optimal for albumin secretion. Compared to the immediate cryopreservation group, significant improvement was observed in viability (61.4% ± 4.8%, 62.0% ± 5.6% vs 53.4% ± 4.2%, both P < 0.05), plating efficiency (63.2% ± 5.8%, 62.6% ± 3.6% vs 55.2% ± 4.6%, both P < 0.05), albumin secretion and urea synthesis (P < 0.05) in cells preincubated at 4 ℃ for 12 and 24 hours.
CONCLUSION: The two-step extracorporeal collagenase perfusion technique provides a novel, simple, and reliable method for hepatocyte isolation. Preincubation of human hepatocytes at 4 ℃ for 12 to 24 hours prior to cryopreservation allows to obtain hepatocytes ideal for use in pharmacotoxicology, bioartificial liver and cell therapy.
- Citation: Hang HL, Zhang L, Shi XL, Bian JM, Ding YT. Isolation, culture and cryopreservation of adult human hepatocytes. Shijie Huaren Xiaohua Zazhi 2011; 19(19): 2016-2021
- URL: https://www.wjgnet.com/1009-3079/full/v19/i19/2016.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i19.2016
成人原代肝细胞是可用于药理毒理学研究、细胞移植、和体外生物人工肝支持系统的一种最适合的细胞模型. 然而, 由于原代人肝细胞来源有限、获取较费时困难且价格昂贵限制了其进一步广泛应用[1]. 当前已有较多有关人肝细胞分离冷冻方法的报道[2,3]. 近年来, 很多方法被使用来提高肝细胞解冻后功能, 例如添加冷冻保护剂[4]、预培养[5,6]、微囊化冷冻[7]等. 然而仍然没有一种可靠、适合的有关成人原代肝细胞分离培养冷冻方法. 因此, 有必要建立一种简单、可靠的方法长期保存大量高质量的肝细胞以便可较方便地获取使用. 本研究的目的是使用部分肝切除后肝脏, 确立一种新的成人原代肝细胞分离、培养及冷冻方法, 通过比较解冻后肝细胞活力的功能, 研究人肝细胞预培养冷冻的效果.
在征得患者同意以及符合伦理委员会规定的条件下, 两年时间共收集从部分肝叶切除等手术中获取的20例成人肝脏标本. 大部分肝脏标本来自肝脏良性疾病(肝血管瘤和肝移植供肝), 有严重传染性疾病(乙、丙型肝炎或艾滋病)、肝硬化肝脏以及根据Vondran等[8]报道GGT>460 U/L的病例都被排除在外. 所有20例患者外科手术均在南京鼓楼医院肝胆外科完成, 手术方法肝血管瘤患者采用Pringle法(间歇阻断15 min)避免对健康肝组织不必要的损伤. 热缺血时间不超过15 min. 从手术患者切除的肝脏组织质量300-400 g, 在手术室当即行肝脏灌洗消化. 消化之后肝脏组织被保存在4 ℃ UW液中并运送至实验室做进一步肝细胞分离, 其中冷缺血时间被控制在20-30 min. Hepatozyme-SFM、Ⅳ胶原酶(Collagenase Ⅳ)、胰酶购自GIBCO公司; 死细胞荧光染料(SYTOX® AADvancedTM Dead Cell Stain Kits)、活细胞荧光染料[(acetoxymethyl, AM)和Acetate Esters]购自invitrogen公司; 二甲基亚砜(DMSO)购自Sigma公司; 白蛋白定量检测ELISA试剂盒(ELISA using goat anti-human albumin)购自Adlitteram Diagnostic Laboratories公司; 尿素浓度定量检测试剂盒(urea assay kit)购自Biochain Institute公司; 肝细胞生长因子(Recombinant Human HGF)购自BioVision公司; UW保存液购自Bristol-Myers Squibb Company; 胎牛血清购自杭州四季青生物工程材料有限公司; 红细胞裂解液购自碧云天生物技术研究所; PBS液的配制: 140 mmol/L NaCL; 2.7 mmol/L KCL; 10 mmol/L Na2HPO4; 1.8 mmol/L KH2PO4. 定容到1 L, pH值调整为7.3; D-Hanks液的配制: NaCl 136.75 mmol/L; KCl 5.37 mmol/L; KH2PO4 0.441mmol/L; NaHCO3 4.17mmol/L. 定容到1 L, pH7.3.
1.2.1 成人原代肝细胞的分离、培养: 肝细胞分离在无菌条件下采用Dorko等[9]报道的两步胶原酶灌注技术, 我们在此基础上进行改进, 称之为"离体两步胶原酶灌注法", 具体如下: 肝叶切除后离体的肝叶立即在D-Hanks液中清洗, 寻找肝叶中的门静脉和肝动脉分支分别用婴儿胃管或输液皮条插管固定作为流入道, 随即D-Hanks液循环灌注至肝脏变土黄, 阻断肝上下腔静脉, 继续用胶原酶灌注消化20-30 min, 切取灌注消化较好的肝脏组织置入4 ℃ UW液中保存运输, PBS冲洗肝组织块, 用小剪刀和镊子将其捣碎, 收集肝细胞悬液过滤网, 将肝脏置于200目不锈钢网筛, 边用玻璃注射器内芯研磨边用PBS冲洗, 收集滤过液1 200 r/min离心3 min去上清, 用滴管吸取上层红细胞沉淀, PBS洗涤后再次离心弃上清, 根据上层红细胞沉淀量加入3-5倍细胞体积的红细胞裂解液, 轻轻吹打混匀, 裂解1-2 min. 4 ℃ 1 200 r/min离心3 min, 弃红色上清, 如果发现红细胞裂解不完全, 可以重复上述步骤1次, PBS洗涤离心直至上清液澄清, 向肝细胞沉淀中加入DMEM培养液, 调整细胞密度接种到培养皿, 待肝细胞贴壁后(约6 h左右)换Hepatozyme-SFM培养液培养, 每2-3 d换液1次, 肝细胞培养1 wk, 台盼蓝拒染试验计算细胞活力>95%者符合下一步实验要求.
1.2.2 成人原代肝细胞的预培养、冷冻及解冻: 肝细胞分离后被重悬在HepatoZYME-SFM无血清预培养液中(pH值调制7.4), 预培养细胞密度调至1×109/L(即5 mL预培养液中加入细胞数量为0.5×107). 实验分为3组(每组n = 6): (1)肝细胞直接培养组(阳性对照组, DC): 将肝细胞分离后直接接种贴壁培养(3×109/L); (2)预培养冷冻肝细胞组(实验组): 指肝细胞冷冻前在4 ℃预先培养一段时间, 选择7个预培养时间点(2、6、12、24、36、48和72 h); (3)肝细胞立即冷冻组(阴性对照组, IC): 将肝细胞分离后直接放置入冷冻盒, 置-80 ℃过夜, 次日投液氮, 冷冻1 wk后复苏测各项指标. 各组肝细胞冷冻密度为1×1010/L; 各冷冻组在液氮冷冻7 d后37 ℃复苏后以3×109/L接种, 肝细胞预培养及复苏后第1次接种均使用无血清人肝细胞培养基, 分别于复苏后1、2、3、4、5、6、7 d观察比较各组肝细胞形态、活力和功能.
1.2.3 肝细胞活力和贴壁率: 各组肝细胞细胞活性及计数测定采用Mahler等[7]报道台盼蓝染色法, 细胞贴壁率计算方法如下: 各组细胞相同数目的肝细胞被接种, 18-20 h后培养基中非贴壁细胞被收集计数, 细胞贴壁率指活性贴壁细胞占最初接种细胞的百分比.
1.2.4 死活细胞荧光染色: 各组肝细胞分离培养或解冻后以3×109/L爬片接种至35 mm×10 mm培养皿, 加培养液过夜培养; 次日吸去培养液, 先用PBS或生理盐水冲洗爬片细胞, Acetoxymethyl(AM)和Acetate Esters(活细胞染料)配制工作浓度1 μmol/L, 吸取200 μL滴入载玻片, 置50 mL/L CO2、37 ℃培养箱孵育20 min, 取出后再次用PBS冲洗干净, SYTOX(死细胞染料)配制工作浓度1 μmol/L, 吸取200 μL滴入载玻片, 4 ℃避光孵育5 min, 取出后再次用生理盐水冲洗干净, 用荧光显微镜观察, 激发光波长分别为488 nm(AM)和530 nm(SYTOX), 发色光波长分别为520 nm(AM)和575 nm(SYTOX).
1.2.5 肝细胞功能检测: 肝细胞功能检测参照我们曾在猪肝细胞研究中的方法[10], 各组肝细胞以1×106 mL接种培养24 h后, 收集上清待检测; 上清中白蛋白分泌定量测定使用抗-人白蛋白ELISA试剂盒(adlitteram diagnostic laboratories Inc., USA), 于波长450 nm的酶标仪上读取各孔的A值, 根据样品的A值查找对应的浓度范围. 尿素合成水平采用尿素检测试剂盒(Biochain Institute Inc., Hayward, USA), 所有操作方法均根据试剂盒说明书.
统计学处理 本实验所涉及的计量资料以mean±SD表示, 两组间数据比较均采用方差分析, 所有数据比较均采用SPSS13.0软件处理, P<0.05有统计学意义.
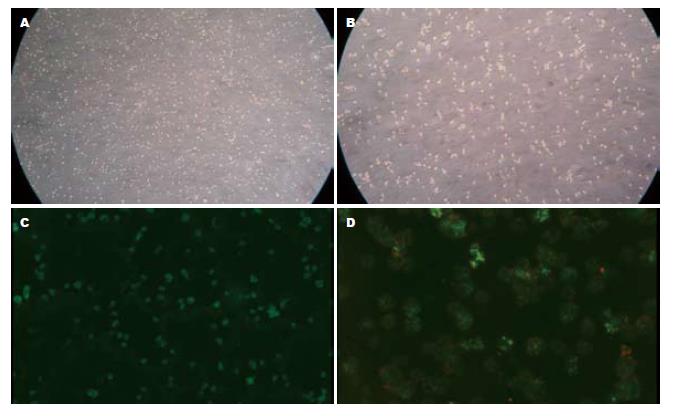
20例肝脏外科标本被成功的行肝细胞分离手术, 结果每克肝组织平均所获有活性肝细胞数目为23.1×106±1.8×106. 分离所得肝细胞活力由胎盼兰拒染试验大于70%, 由大小及形态学判断非实质细胞少于1%(图1A, B). 另外, 死活细胞荧光染色(分别采用calcein-AM和0.5 μmol/L SYTOX Orange dye)也被用来鉴定分离肝细胞的活力, 结果显示出大部分视野可见胞质被染成绿色的活细胞, 极少胞核被染成红色的死细胞(图1C, D).
2.2.1 活率和贴壁率: 与直接培养组比较, 在冷冻解冻后, 冷冻组细胞这些参数均明显减少(P<0.05). 但是, 冷冻前预培养12和24 h两组肝细胞解冻后活率明显较立即冷冻组升高, 差异有统计学意义(61.4±4.8%, 62.0±5.6% vs 53.4±4.2%, P<0.05). 然而, 这两组肝细胞解冻后在纤维蛋白包被皿上的贴壁率也较立即冷冻组明显提高, 差异有统计学意义(63.2±5.8%, 62.6±3.6% vs 55.2±4.6%, P<0.05, 表1).
| IC | 预培养时间(h) | ||||||||
| 2 | 6 | 12 | 24 | 36 | 48 | 72 | DC | ||
| 活率 | 53.4±4.2 | 55.0±4.2 | 56.2±5.5 | 61.4±4.8a | 62.0±5.6b | 55.0±6.0 | 52.2±5.1 | 48.4±4.8 | 75.0±4.6b |
| 贴壁率 | 55.2±4.6 | 56.4±5.6 | 57.0±6.4 | 63.2±5.8a | 62.6±3.6a | 56.8±6.6 | 55.8±6.1 | 51.6±4.9 | 72.0±6.0b |
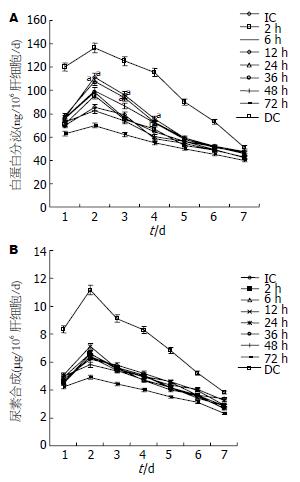
2.2.2 肝细胞功能: 尽管白蛋白分泌随着时间逐渐下降, 但分泌最高峰是在预培养12 h和24 h组, 峰值时间是第2天. 在整个肝细胞培养期间, 这两组在第2、3、4天的白蛋白分泌明显较其他组有所增高(P<0.05). 在其他时间点, 白蛋白分泌较对照组升高, 但其间差异无统计学意义(图2A). 另外, 尿素合成水平随时间的变化趋势与白蛋白一致. 尽管预培养12和24 h组在各时间点较其他组有更高的尿素合成水平, 但其间差异未见统计学意义(图2B).
根据上述实验结果可得出, 成人原代肝细胞冷冻前最适预培养时间是12和24 h, 肝细胞发挥最佳功能是在解冻培养后第2天.
生物人工肝和肝细胞移植通过对肝衰竭患者提供代谢支持, 已经被认为是患者过渡到全肝移植的桥梁[11,12]. 肝细胞移植在治疗特定的代谢性肝脏疾病也可以代替全肝移植[13]. 很多肝脏来源的细胞已经被研究作为分离人肝细胞的替代品, 例如人肿瘤源性肝细胞株[14]、永生化人肝细胞[15,16]以及近来我们已经使用在生物人工肝支持系统中的猪肝细胞[17-19]. 这些来源的细胞若应用于临床都将展现出不同程度的问题及相应的矛盾, 例如新生肿瘤的转移或传播、动物组织的生物安全性和生物相容性问题等. 理论上, 原代人肝细胞将是最适合的肝细胞治疗来源. 目前使用原代人肝细胞主要的障碍是发展一种标准化、高效的肝细胞分离、培养、冷冻方法仍有困难. 因此, 我们提出了一种简单、有效的人肝细胞分离冷冻培养方法, 可以提高肝细胞获得率并可为临床应用和基础研究提供足够数量的人肝细胞.
成人原代肝细胞分离培养方法较多[20], 来源主要有3种, 包括外科手术切除下来后的肝组织[2]、脑死亡供体和肝移植供肝[21]. 我们认为第1种方法是一种方便、经济适合的来源并能够被广泛应用于获取肝细胞. 我们起先使用从肝脏切除的小块肝组织行剖面血管插管, 再通过胶原酶消化[2], 但是最终所得总的有活力肝细胞百分率较低. 因此, 我们选择采用半肝、肝叶或肝段分支血管插管灌注分离肝细胞的方法, 所有上述17例患者均是肝脏标本在手术室刚从腹腔移除就行插管消化, 目的是防止肝脏内血液凝固以及获得充足的灌注和消化; 其他3例肝移植供肝在取肝时已经灌洗彻底完全, 只需消化即可. 采用这种创新的方法可获得高产量、高活力的成人肝细胞. 因此, 我们命名之为离体两步胶原酶灌注技术.
Ellis等[14]发现肝细胞在培养4-5 d后酶释放才达到稳定的水平. Flendrig等[22]发现由肝细胞释放的LDH仅在第1天较明显, GOT水平在第培养3 d后开始下降, 而GPT的释放水平是低的但仅在第1、2天较明显. 这些结果揭示肝细胞膜需要一段时间才能恢复其完整性. Koebe等[23]研究指出猪肝细胞在冷冻保存前最好培养48 h, Terry等[6]发现大鼠肝细胞在冷冻前与冷冻保护剂预培养2 h可提高解冻后细胞的活力和功能. 但是目前为止人肝细胞最适合的预培养时间仍没有被仔细研究, 我们首次比较不同预培养时间点并提出成人肝细胞冷冻前最适的预培养时间是12-24 h. 有关预培养温度, Wigg等[24]报道大鼠肝细胞分离后在25 ℃悬浮培养可维持细胞的功能和完整性. 有报道显示人肝细胞在4 ℃或37 ℃无血清培养基中预培养对解冻后细胞活力和功能无显著差异[6], 然而低温可以减少葡萄糖的消耗, 其可为解冻后细胞能量代谢提供来源. 因此, 我们提出人肝细胞在冷冻前最适的预培养条件为4 ℃ HepatoZYME-SFM中预培养12-24 h. 在这个基础上, 我们采用预培养冷冻的方法来保存肝细胞, 可以建立成人原代肝细胞库, 为进一步临床应用和基础研究提供理想细胞材料.
目前主要有两种冷冻方法被广泛应用, 第1种是由Dou等[25]叙述的采用计算机程序降温仪分级冷冻法, 此种方法我们曾用来冷冻保存猪肝细胞[5]; 第2种是使用异丙醇冻盒的逐级冷冻法, 冷冻盒被放入-80 ℃ 18 h温度以1 ℃/min的速度下降, 次日冷冻肝细胞被投入-196 ℃液氮中. Alexandre等[26]甚至比较不同的方法并发现逐级冷冻结合预培养组贴壁培养人肝细胞解冻后白蛋白分泌、谷胱甘肽含量与新分离培养肝细胞无明显差异. 最终他们提议人肝细胞分离后采用异丙醇逐级冷冻法可以建立人肝细胞库, 为药理毒理学及细胞治疗研究提供细胞材料. 我们也通过比较上述两种冷冻保存肝细胞的方法并发现异丙醇冻盒逐级冷冻法是一种简单、方便且可行的大规模分离、培养、冷冻保存人肝细胞的方法.
总之, 我们通过研究提出成人原代肝细胞在冷冻前最适的预培养条件是4 ℃ HepatoZYME-SFM培养12-24 h, 并且在解冻后第2天可发挥最大肝细胞功能从而用于下一步实验研究和临床应用. 本研究阐述了一种创新、稳定而又简单可行的人肝细胞分离、培养及冷冻方法, 通过这种方法可有望获得高质量的肝细胞并建立冷冻肝细胞库, 为药理毒理学研究、生物人工肝及细胞治疗提供理想细胞材料, 该技术也为将来广泛应用和冷冻肝细胞奠定了坚实的基础. 当然, 有关预培养冷冻效果机制的深入研究以及冷冻过程中对肝细胞的保护仍是下一步要研究的热点.
急性肝功能衰竭(ALF)是指患者突然发生肝细胞坏死或严重的肝功能损害, 并在发病8-24 wk内出现肝昏迷的一种综合征. 肝细胞移植和生物人工肝是目前最有前途的肝脏替代治疗手段. 两种方法都需要充足的肝细胞来源和良好的细胞生物代谢功能. 人肝细胞最为理想, 但其分离、培养、保存较为困难, 要解决这一难题仍需要大量的研究工作.
刘云鹏, 教授, 中国医科大学附属第一医院肿瘤内科
有关预培养冷冻效果机制的深入研究以及冷冻过程中对肝细胞的保护仍是下一步要研究的热点.
有研究表明猪肝细胞冷冻前预培养一段时间可提高细胞解冻后活力和功能.
该方法有望获得高质量的肝细胞并建立冷冻肝细胞库, 为药理毒理学研究、生物人工肝及细胞治疗提供理想细胞材料.
本文探讨了成人原代肝细胞分离、培养、冻存的方法, 结果有一定的创新性和应用价值, 学术价值较好.
编辑:李薇 电编:何基才
| 1. | Ilan Y. Towards a bank of cryopreserved hepatocytes: which cell to freeze? J Hepatol. 2002;37:145-146. [PubMed] [DOI] |
| 2. | Richert L, Alexandre E, Lloyd T, Orr S, Viollon-Abadie C, Patel R, Kingston S, Berry D, Dennison A, Heyd B. Tissue collection, transport and isolation procedures required to optimize human hepatocyte isolation from waste liver surgical resections. A multilaboratory study. Liver Int. 2004;24:371-378. [PubMed] [DOI] |
| 3. | Caruana M, Battle T, Fuller B, Davidson B. Isolation of human hepatocytes after hepatic warm and cold ischemia: a practical approach using University of Wisconsin solution. Cryobiology. 1999;38:165-168. [PubMed] [DOI] |
| 4. | Katenz E, Vondran FW, Schwartlander R, Pless G, Gong X, Cheng X, Neuhaus P, Sauer IM. Cryopreservation of primary human hepatocytes: the benefit of trehalose as an additional cryoprotective agent. Liver Transpl. 2007;13:38-45. [PubMed] [DOI] |
| 5. | Chen Z, Ding Y, Zhang H. Cryopreservation of suckling pig hepatocytes. Ann Clin Lab Sci. 2001;31:391-398. [PubMed] |
| 6. | Terry C, Dhawan A, Mitry RR, Lehec SC, Hughes RD. Preincubation of rat and human hepatocytes with cytoprotectants prior to cryopreservation can improve viability and function upon thawing. Liver Transpl. 2006;12:165-177. [PubMed] [DOI] |
| 7. | Mahler S, Desille M, Frémond B, Chesné C, Guillouzo A, Campion JP, Clément B. Hypothermic storage and cryopreservation of hepatocytes: the protective effect of alginate gel against cell damages. Cell Transplant. 2003;12:579-592. [PubMed] |
| 8. | Vondran FW, Katenz E, Schwartlander R, Morgul MH, Raschzok N, Gong X, Cheng X, Kehr D, Sauer IM. Isolation of primary human hepatocytes after partial hepatectomy: criteria for identification of the most promising liver specimen. Artif Organs. 2008;32:205-213. [PubMed] [DOI] |
| 9. | Dorko K, Freeswick PD, Bartoli F, Cicalese L, Bardsley BA, Tzakis A, Nussler AK. A new technique for isolating and culturing human hepatocytes from whole or split livers not used for transplantation. Cell Transplant. 1994;3:387-395. [PubMed] |
| 10. | Chen Z, Ding Y, Zhang H. Morphology, viability and functions of suckling pig hepatocytes cultured in serum-free medium at high density. Dig Surg. 2002;19:184-191. [PubMed] [DOI] |
| 11. | Strain AJ, Neuberger JM. A bioartificial liver--state of the art. Science. 2002;295:1005-1009. [PubMed] [DOI] |
| 12. | Terry C, Dhawan A, Mitry RR, Hughes RD. Cryopreservation of isolated human hepatocytes for transplantation: State of the art. Cryobiology. 2006;53:149-159. [PubMed] [DOI] |
| 13. | Guha C, Deb NJ, Sappal BS, Ghosh SS, Roy-Chowdhury N, Roy-Chowdhury J. Amplification of engrafted hepatocytes by preparative manipulation of the host liver. Artif Organs. 2001;25:522-528. [PubMed] [DOI] |
| 14. | Ellis AJ, Hughes RD, Wendon JA, Dunne J, Langley PG, Kelly JH, Gislason GT, Sussman NL, Williams R. Pilot-controlled trial of the extracorporeal liver assist device in acute liver failure. Hepatology. 1996;24:1446-1451. [PubMed] [DOI] |
| 15. | Totsugawa T, Yong C, Rivas-Carrillo JD, Soto-Gutierrez A, Navarro-Alvarez N, Noguchi H, Okitsu T, Westerman KA, Kohara M, Reth M. Survival of liver failure pigs by transplantation of reversibly immortalized human hepatocytes with Tamoxifen-mediated self-recombination. J Hepatol. 2007;47:74-82. [PubMed] [DOI] |
| 16. | Wege H, Le HT, Chui MS, Liu L, Wu J, Giri R, Malhi H, Sappal BS, Kumaran V, Gupta S. Telomerase reconstitution immortalizes human fetal hepatocytes without disrupting their differentiation potential. Gastroenterology. 2003;124:432-444. [PubMed] [DOI] |
| 17. | Chen Z, Ding Y, Xu Q, Yu D. Bioartificial liver inoculated with porcine hepatocyte spheroids for treatment of canine acute liver failure model. Artif Organs. 2003;27:613-622. [PubMed] [DOI] |
| 18. | Chu XH, Shi XL, Feng ZQ, Gu JY, Xu HY, Zhang Y, Gu ZZ, Ding YT. In vitro evaluation of a multi-layer radial-flow bioreactor based on galactosylated chitosan nanofiber scaffolds. Biomaterials. 2009;30:4533-4538. [PubMed] [DOI] |
| 19. | Gu J, Shi X, Zhang Y, Ding Y. Heterotypic interactions in the preservation of morphology and functionality of porcine hepatocytes by bone marrow mesenchymal stem cells in vitro. J Cell Physiol. 2009;219:100-108. [PubMed] [DOI] |
| 21. | Baccarani U, Sanna A, Cariani A, Sainz-Barriga M, Adani GL, Zambito AM, Piccolo G, Risaliti A, Nanni-Costa A, Ridolfi L. Isolation of human hepatocytes from livers rejected for liver transplantation on a national basis: results of a 2-year experience. Liver Transpl. 2003;9:506-512. [PubMed] [DOI] |
| 22. | Flendrig LM, la Soe JW, Jörning GG, Steenbeek A, Karlsen OT, Bovée WM, Ladiges NC, te Velde AA, Chamuleau RA. In vitro evaluation of a novel bioreactor based on an integral oxygenator and a spirally wound nonwoven polyester matrix for hepatocyte culture as small aggregates. J Hepatol. 1997;26:1379-1392. [PubMed] [DOI] |
| 23. | Koebe HG, Mühling B, Deglmann CJ, Schildberg FW. Cryopreserved porcine hepatocyte cultures. Chem Biol Interact. 1999;121:99-115. [PubMed] [DOI] |
| 24. | Wigg AJ, Phillips JW, Berry MN. Maintenance of integrity and function of isolated hepatocytes during extended suspension culture at 25 degrees C. Liver Int. 2003;23:201-211. [PubMed] [DOI] |
| 25. | Dou M, de Sousa G, Lacarelle B, Placidi M, Lechene de la Porte P, Domingo M, Lafont H, Rahmani R. Thawed human hepatocytes in primary culture. Cryobiology. 1992;29:454-469. [PubMed] [DOI] |
| 26. | Alexandre E, Viollon-Abadie C, David P, Gandillet A, Coassolo P, Heyd B, Mantion G, Wolf P, Bachellier P, Jaeck D. Cryopreservation of adult human hepatocytes obtained from resected liver biopsies. Cryobiology. 2002;44:103-113. [PubMed] [DOI] |